Was sind einige Beispiele für kovalente Verbindungen?
 Share
Share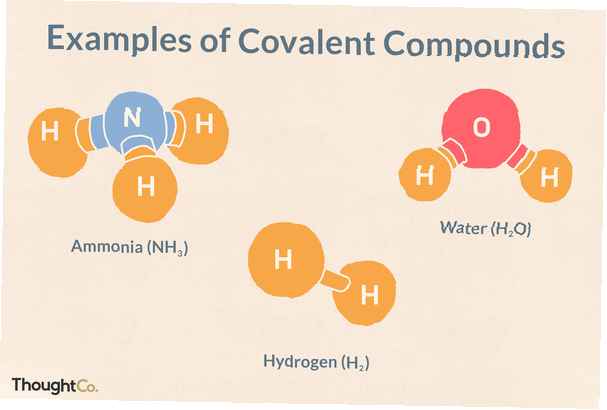
Dies sind Beispiele für kovalente Bindungen und kovalente Verbindungen. Kovalente Verbindungen werden auch als molekulare Verbindungen bezeichnet. Organische Verbindungen wie Kohlenhydrate, Lipide, Proteine und Nukleinsäuren sind Beispiele für molekulare Verbindungen. Sie können diese Verbindungen erkennen, weil sie aus Nichtmetallen bestehen, die aneinander gebunden sind.
PCl3 - Phosphortrichlorid
CH3CH2OH - Ethanol
Ö3 - Ozon
H2 - Wasserstoff
H2O - Wasser
HCl - Chlorwasserstoff
CH4 - Methan
NH3 - Ammoniak
CO2 - Kohlendioxid
So würden Sie zum Beispiel nicht Erwarten Sie kovalente Bindungen in einem Metall oder einer Legierung wie Silber, Stahl oder Messing. In einem Salz wie Natriumchlorid finden Sie eher ionische als kovalente Bindungen.
Was bestimmt, ob sich eine kovalente Bindung bildet??
Kovalente Bindungen entstehen, wenn zwei nichtmetallische Atome die gleichen oder ähnliche Elektronegativitätswerte aufweisen. Wenn sich also zwei identische Nichtmetalle (z. B. zwei Wasserstoffatome) miteinander verbinden, bilden sie eine reine kovalente Bindung. Wenn zwei verschiedene Nichtmetalle Bindungen bilden (z. B. Wasserstoff und Sauerstoff), bilden sie eine kovalente Bindung, aber die Elektronen verbringen mehr Zeit näher an einem Atomtyp als an dem anderen und erzeugen eine polare kovalente Bindung.
