Osmose-Definition in der Chemie
 Share
Share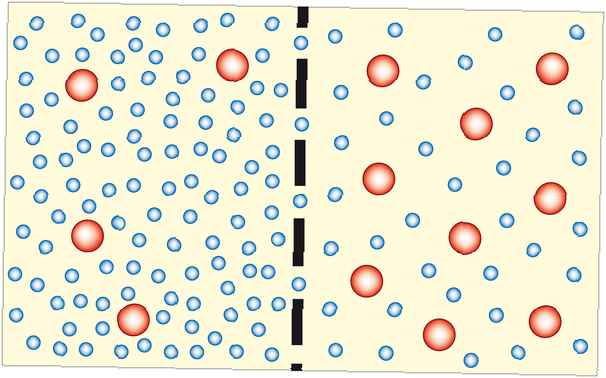
Zwei wichtige Massentransportprozesse in Chemie und Biologie sind Diffusion und Osmose.
Osmose-Definition
Osmose ist der Prozess, bei dem sich Lösungsmittelmoleküle durch eine semipermeable Membran von einer verdünnten Lösung in eine konzentriertere Lösung (die verdünnter wird) bewegen. In den meisten Fällen ist das Lösungsmittel Wasser. Das Lösungsmittel kann jedoch auch eine andere Flüssigkeit oder sogar ein Gas sein. Osmose kann zum Arbeiten gebracht werden.
Geschichte
Das Phänomen der Osmose wurde erstmals 1748 von Jean-Antoine Nollet dokumentiert. Der Begriff "Osmose" wurde vom französischen Arzt René Joachim Henri Dutrochet geprägt, der ihn aus den Begriffen "Endosmose" und "Exosmose" ableitete.
Wie Osmose funktioniert
Durch Osmose wird die Konzentration auf beiden Seiten einer Membran ausgeglichen. Da die gelösten Partikel nicht in der Lage sind, die Membran zu passieren, muss sich das Wasser (oder ein anderes Lösungsmittel) bewegen. Je näher das System dem Gleichgewicht kommt, desto stabiler wird es. Die Osmose ist also thermodynamisch günstig.
Beispiel für Osmose
Ein gutes Beispiel für Osmose ist, wenn rote Blutkörperchen in frisches Wasser gegeben werden. Die Zellmembran der roten Blutkörperchen ist eine semipermeable Membran. Die Konzentration von Ionen und anderen gelösten Molekülen ist innerhalb der Zelle höher als außerhalb, sodass Wasser über Osmose in die Zelle gelangt. Dadurch schwellen die Zellen an. Da die Konzentration kein Gleichgewicht erreichen kann, wird die Menge an Wasser, die sich in die Zelle bewegen kann, durch den Druck der Zellmembran, der auf den Inhalt der Zelle einwirkt, gemildert. Oft nimmt die Zelle mehr Wasser auf, als die Membran aufnehmen kann, wodurch die Zelle platzt.
Ein verwandter Begriff ist osmotischer Druck. Osmotischer Druck ist der externe Druck, der angewendet werden müsste, so dass keine Nettobewegung des Lösungsmittels über eine Membran erfolgen würde.
