Was sind die Elemente im menschlichen Körper?
 Share
Share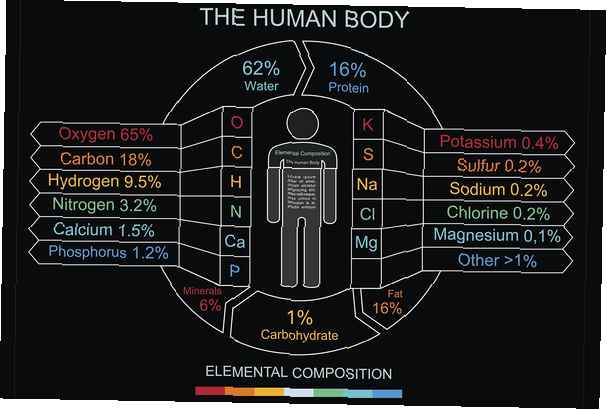
Es gibt verschiedene Möglichkeiten, die Zusammensetzung des menschlichen Körpers zu berücksichtigen, einschließlich der Elemente, der Art des Moleküls oder der Art der Zellen. Der größte Teil des menschlichen Körpers besteht aus Wasser, H2O, mit Zellen, die zu 65-90 Gew .-% aus Wasser bestehen. Daher ist es nicht verwunderlich, dass der größte Teil der menschlichen Körpermasse Sauerstoff ist. An zweiter Stelle steht Kohlenstoff, die Grundeinheit für organische Moleküle. 99% der Masse des menschlichen Körpers besteht aus nur sechs Elementen: Sauerstoff, Kohlenstoff, Wasserstoff, Stickstoff, Kalzium und Phosphor.
- Sauerstoff (O) - 65% - Sauerstoff bildet zusammen mit Wasserstoff Wasser, das im Körper als primäres Lösungsmittel zur Regulierung von Temperatur und osmotischem Druck verwendet wird. Sauerstoff kommt in vielen wichtigen organischen Verbindungen vor.
- Kohlenstoff (C) - 18% - Kohlenstoff hat vier Bindungsstellen für andere Atome und ist damit das Schlüsselatom für die organische Chemie. Kohlenstoffketten werden zum Aufbau von Kohlenhydraten, Fetten, Nukleinsäuren und Proteinen verwendet. Das Aufbrechen von Bindungen mit Kohlenstoff ist eine Energiequelle.
- Wasserstoff (H) - 10% - Wasserstoff kommt im Wasser und in allen organischen Molekülen vor.
- Stickstoff (N) - 3% - Stickstoff kommt in Proteinen und in den Nukleinsäuren vor, die den genetischen Code ausmachen.
- Kalzium (Ca) - 1,5% - Calcium ist das am häufigsten vorkommende Mineral im Körper. Es wird als strukturelles Material in Knochen verwendet, ist jedoch für die Proteinregulation und Muskelkontraktion unerlässlich.
- Phosphor (P) - 1,0% - Phosphor befindet sich im Molekül ATP, dem primären Energieträger in Zellen. Es ist auch in Knochen gefunden.
- Kalium (K) - 0,35% - Kalium ist ein wichtiger Elektrolyt. Es wird verwendet, um Nervenimpulse und Herzschlagregulation zu übertragen.
- Schwefel (S) - 0,25% - Zwei Aminosäuren enthalten Schwefel. Die schwefelhaltigen Bindungen verleihen Proteinen die Form, die sie zur Erfüllung ihrer Funktionen benötigen.
- Natrium (Na) - 0,15% - Natrium ist ein wichtiger Elektrolyt. Wie Kalium wird es zur Nervensignalisierung verwendet. Natrium ist einer der Elektrolyte, die dabei helfen, die Wassermenge im Körper zu regulieren.
- Chlor (Cl) - 0,15% - Chlor ist ein wichtiges negativ geladenes Ion (Anion), das zur Aufrechterhaltung des Flüssigkeitshaushalts verwendet wird.
- Magnesium (Mg) - 0,05% - Magnesium ist an über 300 Stoffwechselreaktionen beteiligt. Es wird verwendet, um die Struktur von Muskeln und Knochen aufzubauen und ist ein wichtiger Kofaktor bei enzymatischen Reaktionen.
- Eisen (Fe) - 0,006% - Eisen ist im Hämoglobin enthalten, dem Molekül, das für den Sauerstofftransport in roten Blutkörperchen verantwortlich ist.
- Kupfer (Cu), Zink (Zn), Selen (Se), Molybdän (Mo), Fluor (F), Jod (I), Mangan (Mn), Kobalt (Co) - insgesamt weniger als 0,70%
- Lithium (Li), Strontium (Sr), Aluminium (Al), Silizium (Si), Blei (Pb), Vanadium (V), Arsen (As), Brom (Br) - in Spuren vorhanden
Viele andere Elemente können in extrem kleinen Mengen gefunden werden. Beispielsweise enthält der menschliche Körper häufig Spuren von Thorium, Uran, Samarium, Wolfram, Beryllium und Radium. Als essentielle Spurenelemente beim Menschen gelten Zink, Jod, möglicherweise Silizium, möglicherweise Bor, Selen, möglicherweise Nickel, Chrom, Mangan, Lithium, möglicherweise Arsen, Molybdän, Kobalt und möglicherweise Vanadium.
Nicht alle im Körper vorkommenden Elemente sind lebenswichtig. Einige gelten als Kontaminanten, die scheinbar keinen Schaden anrichten, aber keine bekannte Funktion haben. Beispiele hierfür sind Cäsium und Titan. Andere sind aktiv toxisch, einschließlich Quecksilber, Cadmium und der radioaktiven Elemente. Arsen gilt als giftig für den Menschen, erfüllt jedoch in Spuren eine Funktion bei anderen Säugetieren (Ziegen, Ratten, Hamster). Aluminium ist interessant, weil es das dritthäufigste Element in der Erdkruste ist und in lebenden Zellen keine bekannte Funktion hat. Während Fluor von Pflanzen zur Herstellung von Schutzgiften verwendet wird, spielt es beim Menschen keine wesentliche biologische Rolle.
Möglicherweise möchten Sie auch die Elementzusammensetzung eines durchschnittlichen menschlichen Körpers nach Masse anzeigen.
Quellen
- Chang, Raymond (2007). Chemie, 9. Ausgabe. McGraw-Hill. ISBN 0-07-110595-6.
- Emsley, John (2011). Die Bausteine der Natur: Eine Anleitung von A bis Z zu den Elementen. OUP Oxford. p. 83. ISBN 978-0-19-960563-7.
- Frausto Da Silva, J.J.R .; Williams, R. J. P. (2001-08-16). Die biologische Chemie der Elemente: Die anorganische Chemie des Lebens. ISBN 9780198508489.
- H. A., V. W. Rodwell; P. A. Mayes, Übersicht über physiologische Chemie, 16. Auflage, Lange Medical Publications, Los Altos, Kalifornien 1977.
- Zumdahl, Steven S. und Susan A. (2000). Chemie, 5. Auflage. Houghton Mifflin Company. p. 894. ISBN 0-395-98581-1.
