Peroxid Definition und Fakten
 Share
Share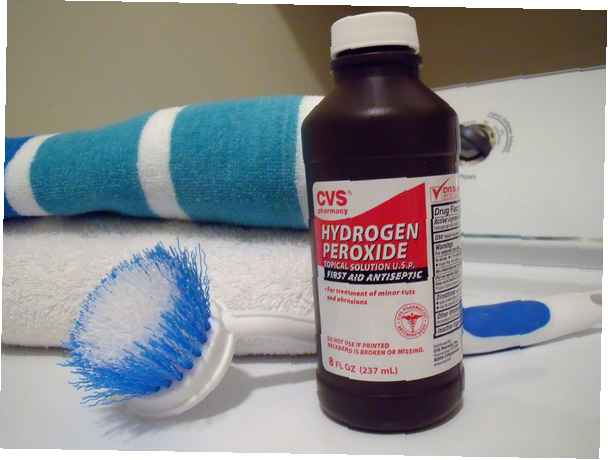
Ein Peroxid ist definiert als ein mehratomiges Anion mit der Summenformel O22-. Die Verbindungen werden im Allgemeinen als ionisch oder kovalent oder organisch oder anorganisch klassifiziert. Die O-O-Gruppe wird als Peroxogruppe oder Peroxidgruppe bezeichnet.
Peroxid bezieht sich auch auf irgendeine Verbindung, die das Peroxidanion enthält.
Beispiele für Peroxide
- Wasserstoffperoxid, H2Ö2, ist eine einfache Peroxidverbindung.
- Andere anorganische Peroxide (außer Wasserstoffperoxid) sind bekannt. Diese werden entweder als ionische Peroxide oder als kovalente Peroxide klassifiziert. Ionenperoxide enthalten Alkalimetallionen oder Erdalkalimetallionen als ihre Kationen. Zu den kovalenten Peroxiden zählen Wasserstoffperoxid sowie Peroxymonoschwefelsäure (H2SO5).
- Technisch gesehen sind Superoxide, Ozone, Ozonide und Dioxygenyle Peroxidverbindungen, die jedoch aufgrund ihrer besonderen Eigenschaften als getrennt angesehen werden.
Vorkommen und Verwendung von Peroxid
- Peroxide kommen natürlicherweise in geringen Mengen in Pflanzen und Tieren, in Wasser und in der Atmosphäre vor. Wasserstoffperoxid ist beim Menschen und bei anderen Tieren ein Nebenprodukt biochemischer Reaktionen. Die Chemikalie ist kurzlebig, aber für Zellen giftig, da sie DNA, Proteine und Membranlipide oxidieren kann. Diese Toxizität macht Peroxid als Desinfektionsmittel nützlich, um Bakterien und andere Krankheitserreger abzutöten. Fast alle eukaryotischen Zellen bilden jedoch absichtlich Peroxid in Organellen, die als Peroxisomen bezeichnet werden. Peroxisomen werden für den Abbau von Fettsäuren, D-Aminosäuren und Polyaminen sowie für die Biosynthese von Verbindungen verwendet, die für eine normale Lungen- und Gehirnfunktion wichtig sind.
- Das Enzym Katalase oxidiert mithilfe von Peroxid Substrate, um Toxine in den Nieren- und Leberzellen zu neutralisieren. Auf diese Weise kann der Mensch beispielsweise Ethanol in Acetaldehyd umwandeln.
- Pflanzen verwenden Wasserstoffperoxid als Signalmittel zur Abwehr von Krankheitserregern.
- Einige Peroxide können organische Moleküle bleichen oder entfärben, daher werden sie Reinigungsmitteln und Haarfärbemitteln zugesetzt.
- Peroxide werden häufig zur Synthese von Arzneimitteln und anderen Chemikalien verwendet.
- Der Bombardierkäfer speichert Hydrochinon und Wasserstoffperoxid in Abdominalreservoirs. Wenn der Käfer bedroht ist, mischt er die Chemikalien miteinander, was zu einer exothermen Reaktion führt, die es dem Käfer ermöglicht, bei einer Bedrohung kochend heiße, stinkende Flüssigkeit zu verspritzen.
Peroxid Sichere Handhabung
Die meisten Menschen sind mit der Wasserstoffperoxidlösung im Haushalt vertraut, bei der es sich um eine verdünnte Lösung von Wasserstoffperoxid in Wasser handelt. Die Art des zur Desinfektion und Reinigung verkauften Peroxids beträgt etwa 3% Peroxid in Wasser. Beim Bleichen von Haaren wird diese Konzentration als V10 bezeichnet. Höhere Konzentrationen können zum Bleichen der Haare oder zur industriellen Reinigung verwendet werden. Während 3% Haushaltsperoxid eine sichere Chemikalie ist, ist konzentriertes Peroxid äußerst gefährlich!
Peroxide sind starke Oxidationsmittel, die schwere Verätzungen verursachen können.
Bestimmte organische Peroxide wie TATP (Triacetontriperoxid)) und HMTD (Hexamethylentriperoxiddiamin), sind hochexplosiv. Es ist wichtig zu verstehen, dass diese höchst instabilen Verbindungen durch Vermischen von Aceton oder anderen Ketonlösungsmitteln mit Wasserstoffperoxid versehentlich hergestellt werden können. Aus diesem und anderen Gründen ist es nicht ratsam, Peroxide mit anderen Chemikalien zu mischen, es sei denn, Sie kennen die resultierende Reaktion vollständig.
Peroxidische Verbindungen sollten in undurchsichtigen Behältern an einem kühlen, vibrationsfreien Ort gelagert werden. Hitze und Licht beschleunigen chemische Reaktionen mit Peroxiden und sollten vermieden werden.
