Spectator Ion Definition und Beispiele
 Share
Share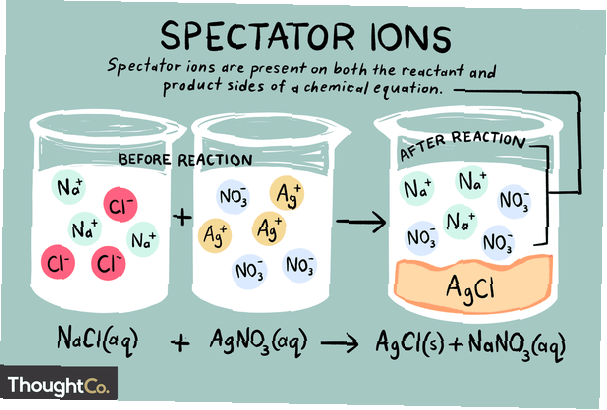
Ionen sind Atome oder Moleküle, die eine elektrische Nettoladung tragen. Es gibt verschiedene Arten von Ionen, einschließlich Kationen, Anionen und Zuschauerionen. Ein Zuschauerion ist eines, das sowohl auf der Reaktanten- als auch auf der Produktseite einer chemischen Reaktion in der gleichen Form vorliegt.
Spectator Ion Definition
Zuschauerionen können entweder Kationen (positiv geladene Ionen) oder Anionen (negativ geladene Ionen) sein. Das Ion ist auf beiden Seiten einer chemischen Gleichung unverändert und beeinflusst das Gleichgewicht nicht. Beim Schreiben einer Nettoionengleichung werden die in der ursprünglichen Gleichung gefundenen Zuschauerionen ignoriert. Und so kam es dass der gesamt Ionenreaktion unterscheidet sich von der Netz chemische Reaktion.
Beispiele für Zuschauerionen
Betrachten Sie die Reaktion zwischen Natriumchlorid (NaCl) und Kupfersulfat (CuSO)4) in wässriger Lösung.
2 NaCl (aq) + CuSO4 (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (s)
Die ionische Form dieser Reaktion ist: 2 Na+ (aq) + 2 Cl- (aq) + Cu2+ (aq) + SO42- (aq) → 2 Na+ (aq) + SO42- (aq) + CuCl2 (s)
Die Natriumionen und Sulfationen sind die Zuschauerionen bei dieser Reaktion. Sie erscheinen sowohl auf der Produkt- als auch auf der Reaktantenseite der Gleichung unverändert. Diese Ionen "beobachten" nur, während die anderen Ionen das Kupferchlorid bilden. Die Zuschauerionen werden aus einer Reaktion gelöscht, wenn die Nettoionengleichung geschrieben wird. Die Nettoionengleichung für dieses Beispiel wäre also:
2 Cl- (aq) + Cu2+ (aq) → CuCl2 (s)
Obwohl Zuschauerionen in der Nettoreaktion ignoriert werden, beeinflussen sie die Debye-Länge.
Tabelle der gemeinsamen Zuschauerionen
Diese Ionen sind Zuschauerionen, da sie nicht mit Wasser reagieren. Wenn sich lösliche Verbindungen dieser Ionen in Wasser auflösen, beeinflussen sie den pH-Wert nicht direkt und können ignoriert werden. Während Sie eine Tabelle konsultieren können, lohnt es sich, sich die gemeinsamen Zuschauerionen zu merken, da es bei einer chemischen Reaktion einfacher ist, starke Säuren, starke Basen und neutrale Salze zu identifizieren, wenn man sie kennt. Sie lassen sich am einfachsten in Gruppen von drei oder drei Ionen erlernen, die sich im Periodensystem der Elemente befinden.
