Trans-Isomer-Definition
 Share
Share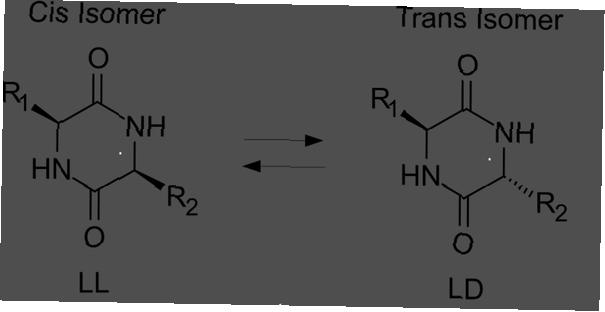
Ein trans-Isomer ist ein Isomer, bei dem die funktionellen Gruppen auf gegenüberliegenden Seiten der Doppelbindung auftreten. Cis- und trans-Isomere werden häufig in Bezug auf organische Verbindungen diskutiert, kommen jedoch auch in anorganischen Koordinationskomplexen und Diazinen vor.
Trans-Isomere werden durch Zugabe identifiziert trans- vor dem Namen des Moleküls. Das Wort trans kommt vom lateinischen Wort "across" oder "auf der anderen Seite".
Beispiel: Das trans-Isomer von Dichlorethen wird geschrieben als trans-Dichlorethen.
Wichtige Imbissbuden: Trans Isomer
- Ein trans-Isomer ist eines, bei dem funktionelle Gruppen an gegenüberliegenden Seiten einer Doppelbindung auftreten. Im Gegensatz dazu sind die funktionellen Gruppen in einem cis-Isomer auf der gleichen Seite.
- Cis- und trans-Isomere weisen unterschiedliche chemische und physikalische Eigenschaften auf.
- Cis- und trans-Isomere haben die gleiche chemische Formel, jedoch eine unterschiedliche Geometrie.
Vergleich von Cis- und Trans-Isomeren
Der andere Isomertyp wird als cis-Isomer bezeichnet. In der cis-Konformation befinden sich die funktionellen Gruppen beide auf derselben Seite der Doppelbindung (nebeneinander). Zwei Moleküle sind Isomere, wenn sie genau die gleiche Anzahl und Art von Atomen enthalten, nur eine unterschiedliche Anordnung oder Rotation um eine chemische Bindung. Moleküle sind nicht Isomere, wenn sie eine unterschiedliche Anzahl von Atomen oder unterschiedliche Arten von Atomen aufweisen.
Trans-Isomere unterscheiden sich von cis-Isomeren nicht nur im Aussehen. Die physikalischen Eigenschaften werden auch durch die Konformation beeinflusst. Beispielsweise neigen trans-Isomere dazu, niedrigere Schmelzpunkte und Siedepunkte als entsprechende cis-Isomere zu haben. Sie neigen auch dazu, weniger dicht zu sein. Trans-Isomere sind weniger polar (unpolarer) als cis-Isomere, da die Ladung auf gegenüberliegenden Seiten der Doppelbindung ausgeglichen ist. Transalkane sind in inerten Lösungsmitteln weniger löslich als cis-Alkane. Trans-Alkene sind symmetrischer als cis-Alkene.
Während Sie vielleicht glauben, funktionelle Gruppen würden sich frei um eine chemische Bindung drehen, sodass ein Molekül spontan zwischen cis- und trans-Konformation wechseln würde, ist dies bei Doppelbindungen nicht so einfach. Die Organisation von Elektronen in einer Doppelbindung hemmt die Rotation, so dass ein Isomer dazu neigt, in der einen oder anderen Konformation zu bleiben. Es ist möglich, die Konformation um eine Doppelbindung herum zu ändern, dies erfordert jedoch Energie, die ausreicht, um die Bindung aufzubrechen und sie dann zu reformieren.
Stabilität von Trans-Isomeren
In acyclischen Systemen bildet eine Verbindung mit größerer Wahrscheinlichkeit ein trans-Isomer als das cis-Isomer, da sie normalerweise stabiler ist. Dies liegt daran, dass beide Funktionsgruppen auf der gleichen Seite einer Doppelbindung eine sterische Hinderung hervorrufen können. Es gibt Ausnahmen von dieser "Regel", wie 1,2-Difluorethylen, 1,2-Difluordiazen (FN = NF), andere halogensubstituierte Ethylen und einige sauerstoffsubstituierte Ethylen. Wenn die cis-Konformation bevorzugt wird, wird das Phänomen als "cis-Effekt" bezeichnet..
Kontrastieren von Cis und Trans mit Syn und Anti
Die Rotation um eine Einfachbindung ist viel freier. Wenn eine Rotation um eine Einfachbindung stattfindet, lautet die korrekte Terminologie syn (wie cis) und Anti (wie trans), um die weniger dauerhafte Konfiguration zu bezeichnen.
Cis / Trans gegen E / Z
Die cis- und trans-Konfigurationen werden als Beispiele für geometrische Isomerie oder Konfigurationsisomerie betrachtet. Cis und trans sollten nicht mit verwechselt werden E/Z Isomerie. E / Z ist eine absolute stereochemische Beschreibung, die nur verwendet wird, wenn auf Alkene mit Doppelbindungen verwiesen wird, die sich nicht drehen können oder Ringstrukturen aufweisen.
Geschichte
Friedrich Woehler bemerkte erstmals 1827 Isomere, als er herausfand, dass Silbercyanat und Silberfulminat die gleiche chemische Zusammensetzung aufweisen, aber unterschiedliche Eigenschaften aufweisen. Im Jahr 1828 entdeckte Woehler, dass Harnstoff und Ammoniumcyanat die gleiche Zusammensetzung und dennoch unterschiedliche Eigenschaften hatten. Jöns Jacob Berzelius stellte den Begriff vor Isomerie im Jahr 1830. Das Wort Isomer kommt aus dem Griechischen und bedeutet "gleichberechtigt".
Quellen
- Eliel, Ernest L. und Samuel H. Wilen (1994). Stereochemie organischer Verbindungen. Wiley Interscience. S. 52-53.
- Kurzer, F. (2000). "Eisenkohlensäure in der Geschichte der organischen Chemie". J. Chem. Educ. 77 (7): 851 & ndash; 857. doi: 10.1021 / ed077p851
- Petrucci, Ralph H .; Harwood, William S .; Herring, F. Geoffrey. Allgemeine Chemie: Prinzipien und moderne Anwendungen (8. Aufl.). Upper Saddle River, NJ: Prentice Hall. p. 91. ISBN 978-0-13-014329-7.
- Smith, Janice Gorzynski (2010). Allgemeine, organische und biologische Chemie (1. Aufl.). McGraw-Hill. p. 450. ISBN 978-0-07-302657-2.
- Whitten K. W., Gailey K. D., Davis R.E. (1992). Allgemeine Chemie (4. Aufl.). Saunders College Publishing. p. 976-977. ISBN 978-0-03-072373-5.
