Arten chemischer Reaktionen
 Share
Share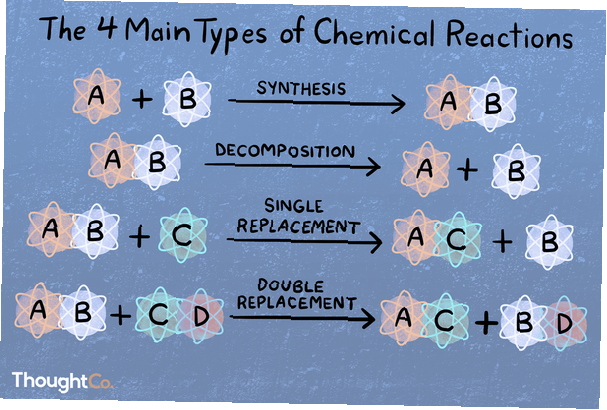
Eine chemische Reaktion ist ein Prozess, der im Allgemeinen durch eine chemische Veränderung gekennzeichnet ist, bei der sich die Ausgangsmaterialien (Reaktanten) von den Produkten unterscheiden. Chemische Reaktionen beinhalten in der Regel die Bewegung von Elektronen, die zur Bildung und zum Aufbrechen chemischer Bindungen führen. Es gibt verschiedene Arten chemischer Reaktionen und mehr als eine Art, sie zu klassifizieren. Hier sind einige gebräuchliche Reaktionstypen:
Oxidation-Reduktion oder Redoxreaktion
Bei einer Redoxreaktion werden die Oxidationszahlen der Atome verändert. Redoxreaktionen können den Elektronentransfer zwischen chemischen Spezies beinhalten.
Die Reaktion, die auftritt, wenn ich2 ist auf I reduziert- und S2Ö32- (Thiosulfatanion) wird zu S oxidiert4Ö62- liefert ein Beispiel für eine Redoxreaktion:
2 S2Ö32−(aq) + I2(aq) → S4Ö62−(aq) + 2 I-(aq)
Direkte Kombination oder Synthesereaktion
In einer Synthesereaktion verbinden sich zwei oder mehr chemische Spezies, um ein komplexeres Produkt zu bilden.
A + B → AB
Die Kombination von Eisen und Schwefel zur Bildung von Eisen (II) sulfid ist ein Beispiel für eine Synthesereaktion:
8 Fe + S8 → 8 FeS
Chemische Zersetzungs- oder Analysereaktion
Bei einer Zersetzungsreaktion wird eine Verbindung in kleinere chemische Spezies gebrochen.
AB → A + B
Die Elektrolyse von Wasser zu Sauerstoff und Wasserstoffgas ist ein Beispiel für eine Zersetzungsreaktion:
2 H2O → 2 H2 + Ö2
Einzelne Verdrängungs- oder Substitutionsreaktion
Eine Substitutions- oder Einzelverdrängungsreaktion ist dadurch gekennzeichnet, dass ein Element durch ein anderes Element aus einer Verbindung verdrängt wird.
A + BC → AC + B
Ein Beispiel für eine Substitutionsreaktion ist die Kombination von Zink mit Salzsäure. Das Zink ersetzt den Wasserstoff:
Zn + 2 HCl → ZnCl2 + H2
Metathese oder Doppelverdrängungsreaktion
Bei einer Doppelverdrängungs- oder Metathesereaktion tauschen zwei Verbindungen Bindungen oder Ionen aus, um unterschiedliche Verbindungen zu bilden.
AB + CD → AD + CB
Ein Beispiel einer Doppelverdrängungsreaktion tritt zwischen Natriumchlorid und Silbernitrat auf, um Natriumnitrat und Silberchlorid zu bilden.
NaCl (aq) + AgNO3(aq) → NaNO3(aq) + AgCl (s)
Säure-Base-Reaktion
Eine Säure-Base-Reaktion ist eine Art Doppelverdrängungsreaktion, die zwischen einer Säure und einer Base auftritt. Das H+ Ion in der Säure reagiert mit dem OH- Ionen in der Base bilden Wasser und ein ionisches Salz:
HA + BOH → H2O + BA
Die Reaktion zwischen Bromwasserstoffsäure (HBr) und Natriumhydroxid ist ein Beispiel für eine Säure-Base-Reaktion:
HBr + NaOH → NaBr + H2Ö
Verbrennung
Eine Verbrennungsreaktion ist eine Art Redoxreaktion, bei der sich ein brennbares Material mit einem Oxidationsmittel zu oxidierten Produkten verbindet und Wärme erzeugt (exotherme Reaktion). Üblicherweise verbindet sich bei einer Verbrennungsreaktion Sauerstoff mit einer anderen Verbindung, um Kohlendioxid und Wasser zu bilden. Ein Beispiel für eine Verbrennungsreaktion ist das Verbrennen von Naphthalin:
C10H8 + 12 O2 → 10 CO2 + 4 H2Ö
Isomerisierung
Bei einer Isomerisierungsreaktion wird die strukturelle Anordnung einer Verbindung geändert, aber ihre Netto-Atomzusammensetzung bleibt gleich.
Hydrolysereaktion
Eine Hydrolysereaktion beinhaltet Wasser. Die allgemeine Form für eine Hydrolysereaktion ist:
X-(aq) + H2O (l) ↔ HX (aq) + OH-(aq)
Die Hauptreaktionstypen
Es gibt hunderte oder sogar tausende Arten chemischer Reaktionen! Wenn Sie aufgefordert werden, die wichtigsten 4, 5 oder 6 Arten chemischer Reaktionen zu benennen, werden sie hier in Kategorien eingeteilt. Die vier Hauptreaktionstypen sind direkte Kombination, Analysereaktion, einfache Verdrängung und doppelte Verdrängung. Wenn Sie nach den fünf Haupttypen von Reaktionen gefragt werden, sind es diese vier und dann entweder Säure-Base oder Redox (je nachdem, wen Sie fragen). Beachten Sie, dass eine bestimmte chemische Reaktion in mehrere Kategorien fallen kann.
