Was sind Elementblöcke?
 Share
Share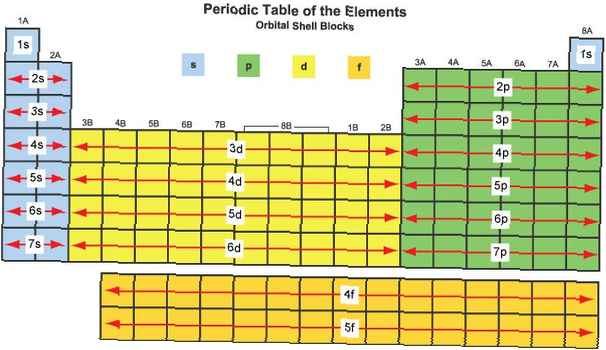
Eine Möglichkeit, Elemente zu gruppieren, sind Elementblöcke, die manchmal als Elementfamilien bezeichnet werden. Elementblöcke unterscheiden sich von Perioden und Gruppen, da sie auf einer ganz anderen Art und Weise der Kategorisierung von Atomen entwickelt wurden.
Was ist ein Elementblock??
Ein Elementblock ist eine Gruppe von Elementen, die sich in benachbarten Elementgruppen befinden. Charles Janet verwendete zuerst den Begriff (auf Französisch). Die Blocknamen (s, p, d, f) stammen aus der Beschreibung der spektroskopischen Linien von Atomorbitalen: scharf, prinzipiell, diffus und fundamental. Bisher wurden keine G-Block-Elemente beobachtet, aber der Buchstabe wurde ausgewählt, da er in alphabetischer Reihenfolge nach 'f' steht..
Welche Elemente fallen in welchen Block??
Elementblöcke werden nach ihrem charakteristischen Orbital benannt, das von den Elektronen mit der höchsten Energie bestimmt wird:
S-Block
Die ersten beiden Gruppen des Periodensystems, die S-Block-Metalle:
- sind entweder Alkalimetalle oder Erdalkalimetalle
- sind weich und haben niedrige Schmelzpunkte
- sind elektropositiv und chemisch aktiv
p-Block
P-Block-Elemente umfassen die letzten sechs Elementgruppen des Periodensystems mit Ausnahme von Helium. Die p-Block-Elemente umfassen alle Nichtmetalle mit Ausnahme von Wasserstoff und Helium, die Halbmetalle und die Metalle nach dem Übergang. P-Block-Elemente:
- Dazu gehören Kohlenstoff, Stickstoff, Sauerstoff, Schwefel, Halogene und viele andere übliche Elemente
- interagieren mit anderen Chemikalien, indem sie die Valenzelektronen verlieren, gewinnen oder teilen
- bilden meist kovalente Verbindungen (obwohl die Halogene ionische Verbindungen mit Blockmetallen bilden)
D-Block
D-Block-Elemente sind Übergangsmetalle der Elementgruppen 3-12. D-Block Elemente:
- haben Valenzelektronen in ihren zwei äußersten und Schalen
- 'd'-Blockelemente verhalten sich in einer Weise, die irgendwo zwischen der von hochreaktiven elektropositiven Alkalimetallen und den die kovalente Verbindung bildenden Elementen liegt (weshalb sie als "Übergangselemente" bezeichnet werden).
- haben hohe Schmelz- und Siedepunkte
- typischerweise bilden sich gefärbte Salze
- sind in der Regel gute Katalysatoren
F-Block
Innere Übergangselemente, üblicherweise die Lanthaniden- und Actiniden-Reihen, einschließlich Lanthan und Actinium. Diese Elemente sind Metalle mit:
- hohe Schmelzpunkte
- variable Oxidationszustände
- die Fähigkeit, gefärbte Salze zu bilden
g-block (vorgeschlagen)
Es wird erwartet, dass der G-Block Elemente mit Ordnungszahlen über 118 enthält.
