Was sind Säuren und Basen?
 Share
Share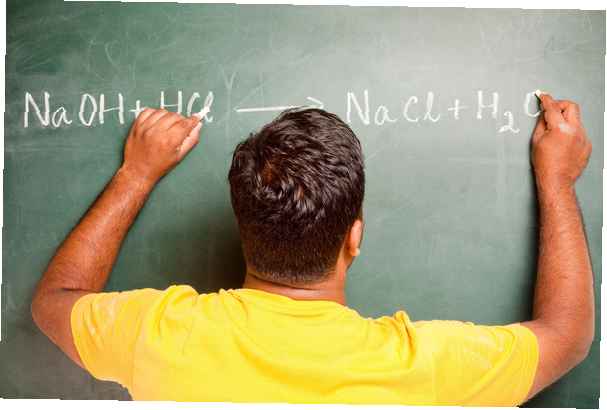
Es gibt verschiedene Methoden zur Definition von Säuren und Basen. Diese Definitionen widersprechen sich zwar nicht, unterscheiden sich jedoch in ihrer Inklusivität. Die gebräuchlichsten Definitionen von Säuren und Basen sind Arrhenius-Säuren und -Basen, Brønsted-Lowry-Säuren und -Basen sowie Lewis-Säuren und -Basen. Antoine Lavoisier, Humphry Davy und Justus Liebig äußerten sich ebenfalls zu Säuren und Basen, formulierten jedoch keine Definitionen.
Svante Arrhenius Säuren und Basen
Die Arrhenius-Theorie der Säuren und Basen geht auf das Jahr 1884 zurück und baut auf seiner Beobachtung auf, dass Salze wie Natriumchlorid in das dissoziieren, was er nannte Ionen wenn in Wasser gelegt.
- Säuren produzieren H+ Ionen in wässrigen Lösungen
- Basen produzieren OH- Ionen in wässrigen Lösungen
- Wasser erforderlich, lässt also nur wässrige Lösungen zu
- nur protische Säuren sind erlaubt; erforderlich, um Wasserstoffionen zu erzeugen
- Es sind nur Hydroxidbasen zulässig
Johannes Nicolaus Brønsted - Thomas Martin Lowry Säuren und Basen
Die Brønsted- oder Brønsted-Lowry-Theorie beschreibt Säure-Base-Reaktionen als eine Säure, die ein Proton freisetzt, und eine Base, die ein Proton aufnimmt. Während die Säuredefinition der von Arrhenius vorgeschlagenen ziemlich ähnlich ist (ein Wasserstoffion ist ein Proton), ist die Definition dessen, was eine Base ausmacht, viel weiter gefasst.
- Säuren sind Protonendonoren
- Basen sind Protonenakzeptoren
- wässrige Lösungen sind zulässig
- Basen neben Hydroxiden sind zulässig
- es sind nur protische Säuren erlaubt
Gilbert Newton Lewis Säuren und Basen
Die Lewis-Theorie der Säuren und Basen ist das am wenigsten einschränkende Modell. Es geht überhaupt nicht um Protonen, sondern ausschließlich um Elektronenpaare.
- Säuren sind Elektronenpaarakzeptoren
- Basen sind Elektronenpaardonoren
- am wenigsten einschränkend für die Säure-Base-Definitionen
Eigenschaften von Säuren und Basen
Robert Boyle beschrieb 1661 die Eigenschaften von Säuren und Basen. Diese Eigenschaften können verwendet werden, um leicht zwischen den beiden chemischen Ansätzen zu unterscheiden, ohne komplizierte Tests durchzuführen:
Säuren
- schmecke sauer (schmecke sie nicht!) - das Wort "Säure" kommt aus dem Lateinischen acere, was bedeutet "sauer"
- Säuren sind ätzend
- Säuren verändern Lackmus (einen blauen Pflanzenfarbstoff) von blau nach rot
- ihre wässrigen (Wasser-) Lösungen leiten elektrischen Strom (sind Elektrolyte)
- reagieren mit Basen unter Bildung von Salzen und Wasser
- Wasserstoffgas entwickeln (H2) bei der Reaktion mit einem aktiven Metall (wie Alkalimetallen, Erdalkalimetallen, Zink, Aluminium)
Gemeinsame Säuren
- Zitronensäure (aus bestimmten Früchten und Gemüse, insbesondere Zitrusfrüchten)
- Ascorbinsäure (Vitamin C, wie aus bestimmten Früchten)
- Essig (5% Essigsäure)
- Kohlensäure (zur Karbonisierung von Erfrischungsgetränken)
- Milchsäure (in Buttermilch)
Grundlagen
- schmecke bitter (schmecke sie nicht!)
- Fühle dich rutschig oder seifig (berühre sie nicht willkürlich!)
- Grundlagen ändern nicht die Farbe des Lackmus; Sie können roten (angesäuerten) Lackmus wieder blau werden lassen
- ihre wässrigen (Wasser-) Lösungen leiten einen elektrischen Strom (sind Elektrolyte)
- reagieren mit säuren zu salzen und wasser
Gemeinsame Grundlagen
- Waschmittel
- Seife
- Lauge (NaOH)
- Haushaltsammoniak (wässrig)
Starke und schwache Säuren und Basen
Die Stärke von Säuren und Basen hängt von ihrer Fähigkeit ab, sich im Wasser zu dissoziieren oder in ihre Ionen zu brechen. Eine starke Säure oder starke Base dissoziiert vollständig (z. B. HCl oder NaOH), während eine schwache Säure oder schwache Base nur teilweise dissoziiert (z. B. Essigsäure)..
Die Säuredissoziationskonstante und die Basendissoziationskonstante geben die relative Stärke einer Säure oder Base an. Die Säuredissoziationskonstante Kein ist die Gleichgewichtskonstante einer Säure-Base-Dissoziation:
HA + H2O ⇆ A- + H3Ö+
wobei HA die Säure ist und A- ist die konjugierte Base.
Kein = [A-] [H3Ö+] / [HA] [H2Ö]
Dies wird zur Berechnung von pK verwendetein, die logarithmische Konstante:
pkein = - log10 Kein
Je größer der pKein Wert, je kleiner die Dissoziation der Säure und je schwächer die Säure. Starke Säuren haben einen pKein von weniger als -2.
